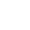头条新闻
当前位置:首页 > 新闻公告 > 头条新闻一、揭示植物天然免疫分子机制
2013年10月10日,清华大学生命科学学院柴继杰教授研究组、中科院遗传与发育研究所周俭民研究员研究组和英国诺维奇科技园圣斯伯利实验室的Cyril Zipfel教授研究组合作,在《科学》在线发表题为《细菌模式分子鞭毛蛋白活化拟南芥模式识别受体FLS2及共受体BAK1复合物的结构基础》(Structural basis for flg22-induced activation of the Arabidopsis FLS2-BAK1 immune complex)的研究论文,首次报道了植物模式识别受体FLS2及共受体BAK1与细菌模式分子鞭毛蛋白保守基序flg22三元复合物晶体结构,并通过结构分析和体内外生化实验揭示了该复合物活化的分子机制。
先天免疫是动植物免疫系统的重要组成部分。在植物的细胞膜上存在多种模式识别受体(pattern recognition receptors,PRRs),通过识别病原体上的一些共有的、保守的分子基序(也即病原相关分子模式pathogen-associated molecular patterns,PMAP),引发先天免疫反应。对细菌运动性极其重要的一种蛋白flagellin是一种典型的PMAP。FLS2是存在于大多数高等植物中,对于抗菌免疫至关重要的一种LRR类型的受体激酶。作为一种典型的PRR,它能够直接识别对细菌运动性极其重要的一种蛋白flagellin的高度保守N末端表位(Flg22),同时遗传及生化实验表明其激活需要另一种LRR受体激酶BAK1的参与,但是其识别鞭毛蛋白的分子机制和激活机制却亟待阐明。
柴继杰研究组利用上海光源生物大分子晶体学线站(BL17U1)解析了FLS2胞外区和BAK1胞外区与植物致病菌丁香假单胞菌鞭毛蛋白保守基序flg22复合物结构(如图),阐明了FLS2胞外区通过其螺线状凹面的连续B片层来识别flg22;结构也提示共受体BAK1仅仅通过N端帽子接触flg22表位的C末端,并且共受体BAK1与FLS2形成广泛的直接相互作用,提示其可能先形成预复合物,以利于对病原菌的侵入做出快速反应。通过与周俭民研究员研究组和Cyril Zipfel教授研究组合作,从体外生化和植物体内实验也验证了flg22激活FLS2的机理:当植物宿主细胞感受到细菌鞭毛蛋白时,细菌鞭毛蛋白通过诱导植物细胞膜上的FLS2和BAK1形成异源二聚化来完成配体感应并激活下游防卫反应信号通路。FLS2LRR-flg22-BAK1LRR是第一个被解析的植物LRR模式识别受体复合物结构。在模式生物拟南芥中有至少含有200多个富含亮氨酸重复的受体激酶(在水稻中大约有600多个),这类LRR-RLKS参与了多种多样的生物过程:调控分生组织的生长、抗病性、激素信号传递和组织发育等。本研究为这一类蛋白结构及功能研究提供了很好的范例,同时对于开发广谱抗病作物品种具有重要的意义。
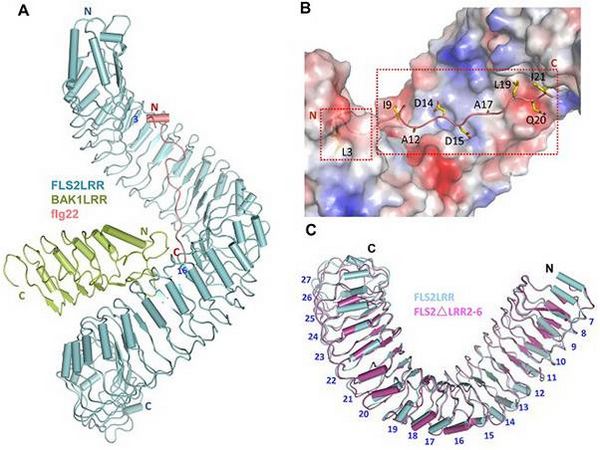
图:FLS2LRR-flg22-BAK1LRR复合物晶体结构
A: FLS2LRR-flg22-BAK1LRR复合物晶体结构 B: flg22结合在FLS2螺旋结构凹面 C:结构比对显示flg22结合没有诱导FLS2构像改变
二、揭示PPR蛋白特异性识别单链RNA的分子机制
2013年10月27日,清华大学颜宁教授研究组在《自然》在线发表论文,报道了PPR蛋白特异性识别单链RNA的分子机制。
PPR(pentatricopeptide repeat)蛋白是广泛分布于各类生物当中一大类蛋白家族,在高等植物叶绿体和线粒体当中尤其种类丰富,比如拟南芥和玉米中各有四百多种PPR蛋白。PPR蛋白对单链RNA具有序列特异性识别模式,与RNA的转录、剪切、编辑、和稳定性等过程都密切相关,因为与包括多种农作物在内的植物细胞质雄性不育有直接联系而受到重视。在人类中,PPR蛋白在包括导致Leigh综合症在内的众多生理和病理过程中发挥重要作用。
PPR蛋白的RNA结合模式与已知的RNA结合蛋白均不同。PPR蛋白由多个PPR重复单元组成,大多数情况下,一个经典的PPR重复单元含有35个氨基酸,每一个重复单元可以特异性地识别一个RNA碱基,近两年的生物信息学和初步生物化学研究研究显示PPR模块与RNA序列有特异的对应关系,但其识别机理及识别密码尚不明确。揭示PPR蛋白特异识别RNA碱基的分子机制对于理解PPR蛋白的工作机理以及促进PPR蛋白生物技术领域的应用具有重要意义。
颜宁教授研究组与施一公、朱健康、王佳伟、王宏伟等课题组合作,选择源自玉米叶绿体的PPR10蛋白进行了深入的结构生物学和生物化学分析,最终利用从上海光源生物大分子晶体学线站(BL17U1)解析了PPR10蛋白在未结合RNA和特异结合靶标PSAJ单链RNA两种状态下的高分辨率晶体结构(如图)。结构显示,PPR10包含19个PPR重复单元,每个PPR重复单元均为helix-loop-helix结构,多个重复单元组成两圈右手超螺旋。PPR10-PSAJ的复合体晶体结构则清晰地揭示了PPR蛋白特异性识别RNA碱基的分子机理。特异识别发生于PPR重复单元的第2、5、35位的氨基酸与相对应的RNA碱基,这一结构生物学发现为破解PPR的RNA识别密码提供了直接的依据。
自然界中有许多具有重复单元构造的蛋白质,其结构与功能的揭示往往可以把这些蛋白质改造为重要的工具蛋白。例如科学家根据TALE蛋白对DNA序列的特异识别,设计组装能够识别任意序列双链DNA的TALEN工具酶,进而对基因组进行改造。TALEN已经在多个物种中获得了广泛应用,这是颜宁课题组与合作者继2012年1月在Science报道TALE蛋白识别双链DNA的分子机制后,对重复单元蛋白的又一项结构与功能研究,希望可以促进PPR在生物技术中的进一步应用。(生命科学研究部 供稿)
图:PPR蛋白晶体结构以及对RNA的特异性识别