研究亮点
当前位置:首页 > 科学研究 > 研究亮点
上海光源生物大分子晶体学线站用户揭示一类全新的植物肽类激素被受体识别的分子机制
时间:2019-07-19



2019年7月10日,清华大学生命学院柴继杰课题组与英国The Sainsbury Laboratory的Cyril Zipfel课题组合作在《自然》(Nature)发表题为“异型受体复合物识别RALF多肽的分子机制”(Mechanisms of RALF peptide perception by a heterotypic receptor complex)的研究论文。该研究通过解析RALF23-LLG2-FER复合物晶体结构并结合体内功能与体外生化实验,阐明了植物RALF多肽被CrRLK1L型受体激酶与膜锚定GPI蛋白异型识别的分子机制,这种新颖的识别模式为相关蛋白家族的功能研究提供了全新范式。
拟南芥基因组编码600余个受体激酶样(Receptor like kinase, RLK)基因,它们通过识别包括自身的激素信号、小肽信号及外源病原相关分子模式(PAMP)等不同的配体,介导植物细胞膜内外信号的交流。根据受体激酶胞外结构域的组成,这些RLK可分为约15个亚家族。在过去十年间,柴继杰教授研究组集中研究了其中3个亚家族的结构与功能(LRR-RLK、LysM-RLK、G-type Letin-RLK),总结提出了植物受体激酶的同源或异源二聚化活化模型,相关文章均发表在国际顶尖期刊,获得了国内外相关专家的高度认可。柴继杰教授团队也因“植物油菜素内酯等受体激酶的结构及功能研究”,荣获2017年度国家自然科学二等奖。
拟南芥受体激酶Feronia (FER) 是另外一类植物受体激酶CrRLK1L亚家族的成员。CrRLK1L亚家族的成员胞外具有两个特征性的与配体识别相关的串联Malectin结构域。动物Malectin是定位于内质网膜上的蛋白,可特异性识别糖类分子,与蛋白的糖基化修饰有关。植物Malectin结构域同样被报道可识别细胞壁相关多糖pectin。
在本项研究中,柴继杰团队利用上海光源生物大分子晶体学线站(BL17U1)解析了apo-FER, apo-ANX1, apo-ANX2, apo-LLG1和RALF23-LLG2-FER复合物五个晶体结构。结合体内功能遗传实验与体外多种生化手段首次展示了植物多肽RALF被受体激酶-膜锚定蛋白这一异型受体复合物识别的分子机制。拟南芥体内约有250个GPI蛋白,大部分研究表明GPI蛋白作为相关膜蛋白的chaperone,起到帮助膜蛋白在细胞膜系统上运输的作用,目前尚未有植物GPI蛋白直接识别配体的报道。而本项究表明,GPI蛋白LLG1/2/3可作为受体在膜上直接识别配体RALF,并在配体RALF的诱导下形成新的作用面以结合受体激酶FER,使
FER-LLG这一异型受体复合物共同完成对配体RALF的识别。
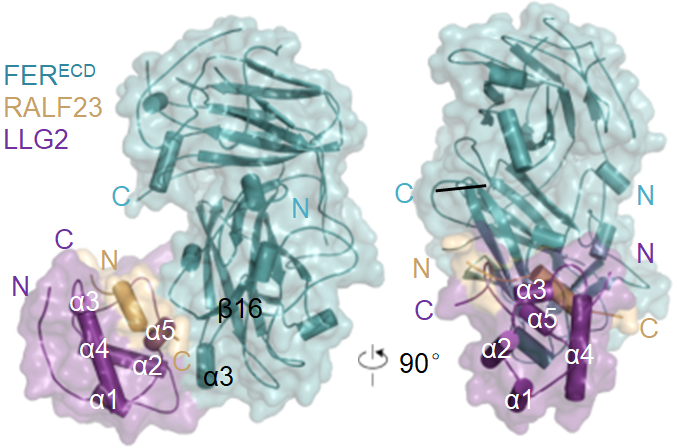
FER-RALF23-LLG2的结构模式图
有别于过去研究发现的受体激酶基于同型二聚或多聚来识别配体的传统模式,本项研究揭示的受体激酶与膜锚定蛋白形成异型复合物识别配体的模式,为植物受体激酶以及膜锚定蛋白的结构功能研究提供了全新的范例。本项研究也纠正了植物Malectin也会识别多糖的认识,证明了动植物Malectin结构域在分别进化后,已获得了截然不同的配体识别功能。
原文链接:https://www.nature.com/articles/s41586-019-1409-7