研究亮点
当前位置:首页 > 科学研究 > 研究亮点2017年1月23日,中山大学肿瘤防治中心高嵩教授课题组在《自然》(Nature)发表题为“MFN1 structures reveal nucleotide-triggered dimerization critical for mitochondrial fusion”的研究论文。该工作利用上海光源生物大分子晶体学线站(BL17U1)解析了MFN1片段在不同GTP水解状态下的晶体结构,阐明了MFN1水解GTP的机制,并提出了MFN1介导线粒体外膜栓连的模型。这为进一步阐明线粒体外膜的融合机制以及线粒体形态的变化和相应生理功能的正常发挥之间的关系提供了研究基础。同时,还为研究相关神经退行性疾病和癌症的发病机制以及干预手段提供了信息。
线粒体是一种存在于大多数真核细胞中的由两层膜包被的半自主细胞器。线粒体是细胞的“能量工厂”,并且在细胞信号转导、分化和凋亡等过程中也发挥重要作用。在细胞中,线粒体不断地进行融合和分裂来维持动态的网络结构和正常的生理功能。线粒体外膜的融合是由一种名为mitofusin的蛋白所介导的。人体中的mitofusin包含MFN1和MFN2(统称MFNs)两个同源蛋白。MFNs功能的异常会导致线粒体呈现碎片化的非正常形态,并且与多种疾病密切相关。例如, MFN2突变可以导致遗传性疾病腓骨肌萎缩症的发生,MFN1和MFN2的异常表达与肿瘤细胞逃避细胞凋亡有密切的关系。MFN1/2是dynamin超家族的成员,二者的序列相似度高达77%。它们都含有一个N端的GTPase结构域、两个紧邻的跨膜区(TMs),以及分别位于膜两侧的两个螺旋结构域HR1和HR2。其中,MFN1/2的TMs插入线粒体外膜,其余部分朝向细胞质。GTPase 结构域主要起催化水解 GTP 的作用,而 HR1/2可能起调节线粒体膜毗连或融合的作用。大量研究表明,MFN1/2的GTPase活性对线粒体外膜的融合是必须的。此前,有关mitofusin的结构学信息只涉及MFN1 HR2区域。该结构显示,HR2在晶体上折叠成反向平行的二聚体。他们认为这种反向平行的两股螺旋(coiled coil)结构为线粒体毗连(tether)甚至融合(fusion)提供了结构基础。然而,mitofusin由于缺乏较为完整晶体结构,其介导线粒体外膜融合的分子机制仍不是很清楚。
中山大学肿瘤防治中心高嵩教授带领的研究团队经过不懈地摸索和尝试,得到一系列结晶的构建——内部截短的MFN1(MFN1IM),并解析了MFN1IM在不同GTP水解状态下的晶体结构。结构显示,GTPase结构域由8股α螺旋包裹着8条β折叠组成;HR1/2的两个部分利用强的疏水相互作用一起组成四股螺旋束,被命名为结构域HD1。HD1通过Arg74和Lys336与GTPase结构域连接。相对于无核苷酸结合(apo)、GDP或GTP结合状态下的单体结构,MFN1IM在催化间态类似物GDP•AlF4-结合的状态下通过GTPase结构域形成二聚体。体外实验也证实了这种二聚体的存在。一旦打断GTPase结构域相互作用(G-G)界面的盐桥,MFN1在催化间态无法发生二聚化,并且丧失GTP酶活性以及导致线粒体片段化。他们还发现一个保守的色氨酸开关控制鸟苷酸配体的进入。在apo状态下,鸟苷酸结合位置被Trp239占据。随着GTP的进入,Trp239被推走,嵌入由Met249和Phe282形成的疏水口袋。与此同时,催化间态下二聚体形成的关键氨基酸Glu209、Arg238等摆向合适的位置以利于与另一个GTPase结构域相应氨基酸形成盐桥。在催化间态,GTP中高能磷酸键断裂,磷酸基团尚未脱离,MFN1IM通过Glu209和Arg238等氨基酸搭成的盐桥发生二聚化。随着磷酸基团的释放,相应氨基酸又逐渐恢复最初构象。GTP的水解需要亲核试剂去中和高能磷酸键中的磷酸基团所携带的强负电。在MFN1中,存在一个带正电的氨基酸残基His107发挥亲和攻击的作用。因而,mitofusin保守的His107是催化水解GTP的关键氨基酸。
与dynamin家族其他成员相比较,发现MFN1IM的拓扑结构与介导细菌膜融合的蛋白BDLP(bacteria dynamin-like protein)最为相似。除了GTPase结构域,MFN1IM的HD1与BDLP的neck相似。因而,他们推测,MFN1IM缺失的部分HD2的折叠可能跟BDLP的trunk区域相似。基于MFN1IM与BDLP三维结构的高相似度和前面的研究,他们提出了MFN1介导线粒体外膜栓连的模型。(生命科学研究部 供稿)
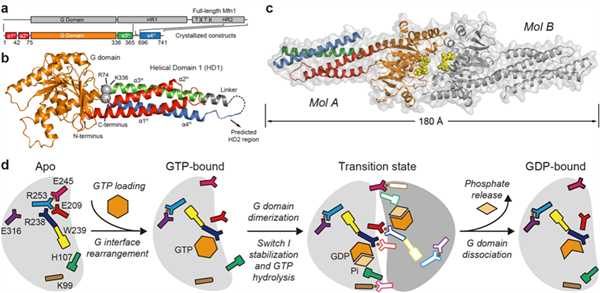
MFN1的晶体结构和水解GTP机制的模型图
原文链接: http://www.nature.com/nature/journal/vaop/ncurrent/full/nature21077.html