上海光源生物大分子晶体学线站用户取得新成果
一、揭示NLRC4蛋白自抑制作用的分子机制
6月14日,清华大学生命科学院柴继杰教授研究组在《科学》杂志在线发表了题为《NLRC4蛋白自抑制机制的结构基础》(Crystal structure of NLRC4 reveals its autoinhibition mechanism)的研究论文,首次报道了小鼠NOD样受体NLRC4自抑制状态的晶体结构,并通过结构分析和生化实验揭示了该蛋白维持自抑制作用的分子机制,这也是NOD样受体家族中第一个被解析出的近乎全长的蛋白质晶体结构。
NOD样受体为近年来发现的一类位于细胞质内的模式识别受体,能够识别进入胞内的病原分子从而引起免疫应答,是机体天然免疫系统的重要组成部分。NOD样受体的异常与很多疾病密切相关,包括如关节炎等各种自身免疫疾病、肥胖等各种代谢综合症、炎症性肠病以及肿瘤的发生。对该家族蛋白作用机制的研究正成为基础免疫学领域的一个重要的热点领域。
目前已经鉴定出的NOD样受体家族至少包含22种人类成员和34种鼠源成员。NLRC4是NOD样受体家族中的一员,主要识别细菌的鞭毛蛋白和III型分泌系统的成分。NLRC4在正常情况下通过自抑制作用处于静息状态;当病原体成分进入细胞内时,被NLRC4识别从而使其活化;活化的NLRC4发生自身多聚化,形成炎症小体,产生一系列的免疫应答反应。目前对NLRC4以及该家族其它蛋白是如何维持自抑制状态、如何识别配体以及如何激活等问题都不清楚。
柴继杰教授领导的研究组一直以NOD样受体家族的结构与功能作为主要研究方向。利用上海光源生物大分子晶体学线站(BL17U1)成功解析了小鼠NLRC4蛋白晶体的相位。最终的晶体结构分辨率是3.2Å,结构显示单独的NLRC4蛋白以单体的形式处于自抑制状态。该蛋白中的核苷酸结合结构域(nucleotide-binding domain,NBD)结合的是ADP,ADP介导的NBD同侧翼螺旋结构域(winged-helix domain,WHD)之间的相互作用对维持NLRC4的自抑制状态十分关键。螺旋结构域2(helical domain 2,HD2)通过和NBD中一段功能重要的α螺旋相互作用也参与了维持NLRC4的自抑制状态。C末端的富含亮氨酸重复序列(leucine-rich repeat,LRR)结构域正好处于该蛋白发生多聚化的位置,从而进一步保证自抑制状态的维持。当通过氨基酸突变的方法打破NBD-WHD、NBD-HD2或NBD-LRR之间的相互作用后,这些突变体在细胞内组成型激活NLRC4。以上的结构和生化结果表明,NLRC4蛋白是通过以NBD为中心多个结构域协同的方式维持自抑制状态。NLRC4蛋白自抑制作用分子机制的揭示不仅加深了对该家族蛋白静息状态维持机制的认识,也为了解一些疾病相关突变体异常激活的原因提供了重要线索。
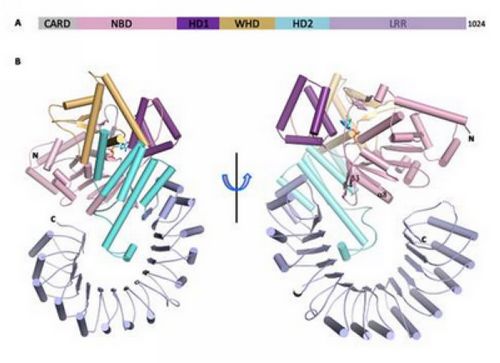
图为小鼠NOD样受体NLRC4自抑制状态的晶体结构
二、新冠状病毒侵入宿主细胞机制研究方面取得重要进展
7月7日,中国科学院微生物研究所高福研究组在《自然》杂志在线发表题为“Molecular basis of binding between novel human coronavirus MERS-CoV and its receptor CD26”的研究论文,报道了他们在新冠状病毒侵入宿主细胞机制研究方面取得重要进展。
新冠状病毒,又称中东呼吸系统综合征冠状病毒(Middle East Respiratory Syndrome coronavirus,MERS-CoV),是继SARS-CoV之后出现的又一个高致病性冠状病毒。与SARS相似,MERS-CoV感染患者可出现发烧,咳嗽和急性呼吸窘迫综合征,有时伴有肾衰竭,病死率非常高。自2012年9月首次报道以来,截至2013年7月5日,全球共向世卫组织通报79例MERS-CoV病毒感染实验室确诊病例,其中42例死亡。迄今,约旦、卡塔尔、沙特阿拉伯、阿拉伯联合酋长国、法国、德国、意大利、突尼斯和英国均已报告实验室确诊病例;在法国、意大利、突尼斯和英国还发生了有限的本地传播。一时间,MERS-CoV的高病死率、人传人的能力以及向其他国家蔓延的趋势引起各方重视和担忧。因此了解MERS-CoV侵入宿主细胞的机制非常重要。
MERS-CoV与SARS-CoV同属冠状病毒科,beta冠状病毒属,为具囊膜的正链RNA病毒。病毒囊膜上含有刺突蛋白(spike, S),介导病毒对宿主特异性受体分子的结合,是起始病毒感染的最重要的分子。最近的研究表明,二肽基肽酶-4(dipeptidyl peptidase 4, DPPIV/CD26)是MERS-CoV在宿主细胞的受体。鉴定MERS-CoV S蛋白与CD26的结合模式,对于MERS-CoV病毒侵入机制研究和有效药物靶点的发现具有重要意义。高福研究组长期致力于囊膜病毒跨种间传播机制与免疫分子识别研究,针对新发现的病毒受体分子,迅速开展了复合物结构及相互作用的功能研究。
研究人员首先鉴定了S蛋白中负责与CD26结合的部分,即受体结合域 (receptor binding domain of MERS,MERS-RBD);然后成功制备了高纯度的MERS-RBD以及与CD26的蛋白复合物,并获得了高质量的晶体。利用上海光源生物大分子晶体学线站(BL17U1)最终解析了MERS-RBD单体以及配体/受体复合物的分子结构。MERS-RBD由核心区和外部受体识别区组成(如图a),核心区结构与SARS-CoV的刺突分子同源,而外部受体识别区呈现为由β-折叠片构成的独特的结构单元,识别CD26分子“β-螺旋桨”样结构中的IV,V桨页片。CD26属于II型跨膜蛋白,以二聚体形式存在于细胞膜上,MERS-RBD结合在CD26的远膜端,形成类似U-型的分子结构(如图b)。在病毒配体识别受体的过程中,侧链基团形成的氢键与盐桥等亲水相互作用至关重要。这些分子层面上的互作细节,为设计靶向病毒侵入的小分子药物提供了重要的参考。
MERS-CoV对公共卫生安全的潜在威胁亟需特异、高效的抗MERS-CoV病毒药物。阻断病毒的结合和侵入,防患于未然,是最有效的抗病毒手段之一。研究组MERS-RBD和CD26结合模式的研究成果对抗MERS-CoV病毒的药物设计具有重要的指导意义。
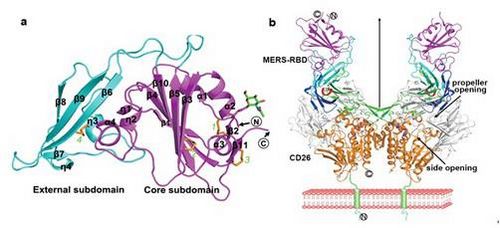
图为MERS-RBD以及RBD/CD26复合物的晶体结构
附件下载:
