上海光源生物大分子晶体学线站用户接连在《自然》发表两项研究成果
一、葡萄糖转运蛋白GLUT1-4的结构与机理研究
2012年10月18日,清华大学医学院颜宁教授研究组在Nature以Research Article的形式发表了题为Crystal structure of a bacterial homologue of glucose transporters GLUT1-4的研究论文,报道了人的葡萄糖转运蛋白GLUT1-4在大肠杆菌中的同源蛋白XylE的晶体结构,并且运用生化手段对其工作机理进行了研究。
从低等微生物到高等动物如人类,葡萄糖代谢对于细胞维持正常生理功能有着至关重要的作用。但是葡萄糖无法自由通过由膦脂双分子层构成的疏水细胞膜,细胞对葡萄糖的摄入需要借助于细胞膜上的葡萄糖转运蛋白,其中一类属于主要协同转运蛋白超家族(Major Facilitator Superfamily,简称MFS),它是大脑、神经系统、红细胞、各个器官中最重要的葡萄糖转运蛋白(glucose transporters,简称GLUT)。这类葡萄糖转运蛋白家族包含多个成员,其中科学家对GLUT1、GLUT2、GLUT3、GLUT4这四个蛋白研究最为深入,且证实与多种人类疾病的产生密切相关,如婴儿癫痫发作、Fanconi-Bickel综合症、糖尿病、肥胖等。但是目前科学界对这一类重要蛋白的结构信息知之甚少。
颜宁教授领导的研究组一直将人体葡萄糖转运蛋白及其在各物种中同源蛋白的结构与功能研究作为主要方向。XylE是大肠杆菌中负责将D-木糖以质子依赖的方式同向转运进入细胞。它与人的GLUT1-4蛋白有着高达50%的序列相似性,进化上高度保守。利用上海光源生物大分子晶体学线站,颜宁研究组获得了XylE与其两个抑制剂的复合体结构,加上使用日本SPring-8光源获得的XylE与底物D-木糖的复合物结构,共得到了三个复合物结构。XylE蛋白的三维晶体结构呈现出典型的MFS家族折叠方式——由12个跨膜螺旋组成N端和C端两个以假两次轴对称的结构域。与已知结构的MFS超家族其它成员不同,XylE呈现出一种向细胞外侧开放、部分封闭的全新构象,并且具有一个独特的由4个α螺旋组成的胞内结构域。她们在获得的三个复合物的结构中找到了与底物结合的重要氨基酸残基,并通过生化实验分析,验证了这些残基在底物识别与转运过程中起到的作用。尤为重要的是,序列比对显示这些残基在GLUT1-4中完全保守,从而第一次揭示出 GLUT1-4识别底物的分子基础。利用计算机软件同源建模,研究组搭建了人的GLUT1蛋白的三维结构。这一结构模型由于是以具有高度同源的XylE蛋白的晶体结构为基础,比以往研究报道的结果更为准确。根据这个结构模型,研究组进一步研究了GLUT1-4与相关人类疾病相关的突变残基的功能与致病机理。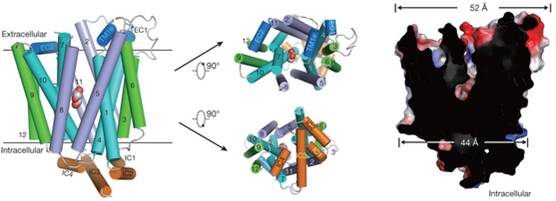
二、一类新型抗生素药物靶点的结构与功能研究
2012年10月21日,清华大学生命学院杨茂君研究组在Nature在线发表了题为Structural insight into the type-II mitochondrial NADH dehydrogenases的科研论文,首次报道了二型NADH-泛醌氧化还原酶Ndi1的晶体结构,并对其生理功能和工作机制进行了详细的研究。
位于线粒体内膜上的呼吸链是生物体最重要的能量来源,由复合物I-V组成,它将代谢过程中产生的电子从NADH或FADH2向氧分子传递的系统,最终生成ATP为生物体提供能量。其中的复合物I,又称NADH-泛醌氧化还原酶(NDH-1),是这些电子进入电子传递链最重要的入口。在多种生物中,复合物I可以被一类称为二型NADH氧化还原酶(NDH-2)的蛋白所取代,这类蛋白以FAD为辅基催化电子从NADH传递给泛醌(UQ)。NDH-2在多种病原微生物中高度保守,如结核杆菌、疟原虫、刚地弓形虫等。由于在呼吸链中的重要地位,这类蛋白一直被认为是一个重要的药物靶点。同时,很多人类疾病尤其是帕金森氏病等神经退行性疾病都与复合物I的缺陷有关,而外源表达的Ndi1蛋白(酿酒酵母的一种NDH-2)可以在包括小鼠在内的多种生物中取代缺陷的复合物I使机体恢复正常。此外该蛋白在果蝇中的表达可以大大延长果蝇的寿命。因此Ndi1也被认为是一个潜在的基因治疗靶点。
自NDH-2于1966年被首次发现以来,人们对其生化特性和催化机制进行了大量的研究。但由于缺少这类蛋白的结构信息,现有的许多生化数据始终得不到很好的解释,而且存在多处矛盾亟待解决。杨茂君研究组经过多年的不懈努力,最终利用上海光源生物大分子晶体学线站成功解析了Ndi1这一重要蛋白质的高分辨率晶体结构及Ndi1与NADH、UQ以及NADH-UQ三种底物复合物的晶体结构。有趣的是,在所有晶体结构中,Ndi1均以同源二聚体形式存在,这与先前认为其可能以单体形式发挥功能的猜测不同。生物信息学和结构分析发现,Ndi1具有一个在NDH-2中高度保守的C端结构域(CTD),该结构域介导了Ndi1二聚体化,进而使其形成一个广泛的疏水区域,这赋予了Ndi1附着在线粒体内膜上的特性。随后的生物化学和细胞生物学实验都证实了以上的观点。同时,三种Ndi1-底物复合物结构的解析首次证明了在Ndi1中同时存在两个泛醌结合位点。结合电子顺磁共振实验的结果,最终提出了Ndi1催化电子从NADH传递给泛醌UQ的机制。这些研究结果不但很好的解释了当前许多看似相互矛盾的生化数据,而且为研究NDH-2介导电子传递的详细机制、针对NDH-2的药物设计以及更好地将Ndi1应用于基因治疗提供了基础。
在该研究中,杨茂君课题组主要通过大量的结构生物学研究提出了该家族蛋白的可能的工作机制,然后综合运用了生物信息学、生物化学与分子生物学、细胞生物学、遗传学、以及物理学等多学科手段证明了这些发现,系统地研究了该家族最具代表性的蛋白Ndi1的各方面特性,全方位地展示了该蛋白发挥其线粒体呼吸链电子传递入口这一重要生物学功能的机理,是迄今已报道的对该蛋白家族的研究中最系统、最全面的一次研究。研究中所涉及的四个晶体结构全部是利用上海光源成功测定,上海光源为该项研究的完成提供了及时有效的支持。(生命科学研究部 供稿)
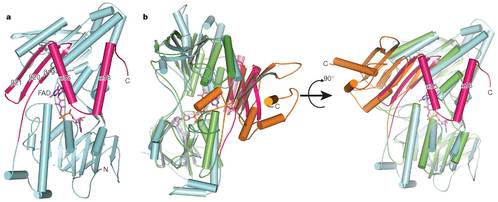
二型NADH-泛醌氧化还原酶Ndi1的晶体结构
附件下载:
