您现在的位置:首页 > 头条新闻
上海光源(SSRF)生物大分子晶体学线站用户、清华大学医学院教授颜宁领导的研究组与生命学院王佳伟博士、龚海鹏博士,合作开展大肠杆菌岩藻糖(L-fucose)转运蛋白(FucP)结构与功能的研究,揭示了FucP在底物识别和转运,以及质子传递偶联过程中起关键作用的残基D46和E135,为理解MFS家族提供了一个新的重要研究系统。相关论文于9月27日在线发表在Nature杂志。文章报道两个结构,其中一个结构(FucP-N162A)的数据完全在SSRF上收集。
FucP从属于Major Facilitator Superfamily (MFS)超家族。MFS超家族转运蛋白是一类非常古老、在各个物种中都起着重要作用的转运蛋白,目前已知一级序列的家族成员超过一万个,它们在营养物质和代谢产物的转运、细菌抗药性以及神经信号传导等各种生理过程中起着重要作用。由于MFS转运蛋白的重要生理功能,它们的结构与功能受到了广泛的关注。然而迄今为止,这个家族中只有三个蛋白的结构被报道,并且观测到的仅有向胞内开放与两端封闭两种构象。一直以来,为了证明最基本的转运原理适用于MFS家族,本领域迫切希望获得向胞外开放的MFS转运蛋白的构象。
为理解MFS蛋白的工作机理,颜宁研究组选择了糖转运蛋白的代表FucP作为研究对象, FucP是一类依赖于质子梯度的同向共转运蛋白(Proton Symporter),具有高度的底物特异性。经过一年半的探索,2009年秋 分别在日本SPring-8和SSRF生物大分子晶体学线站(BL17U)上获得了FucP在3.1埃分辨率的晶体结构。此结构显示FucP处于向胞外开放的构象,这是第一个MFS家族的此类结构,原则上证明了MFS家族两个构象互变以转运底物的猜想。FucP分为N和C两个结构域,转运通道一目了然。
膜蛋白的结构生物学研究一直以来是结构生物学领域公认的重点及难点。上海同步辐射光源的投入使用,使中国结构生物学家的数据收集变得及时迅速,为我国结构生物学家提供了关键的技术支持。
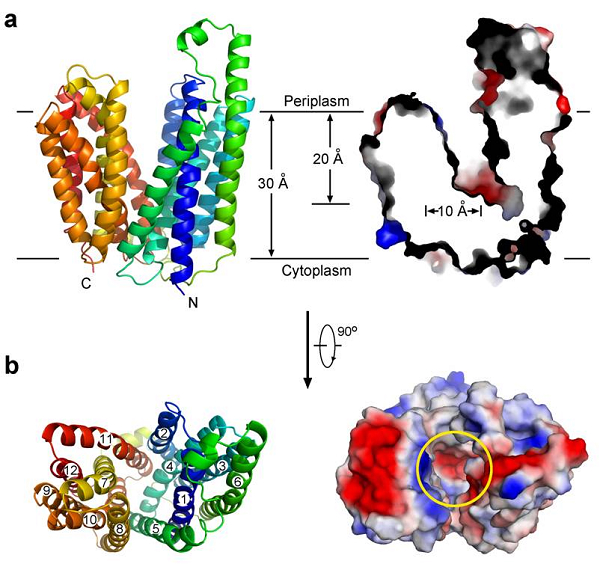
FucP蛋白结构及表面静电势分布








