上海光源生物大分子晶体学线站用户在新型阳离子通道结构与门控机制研究方面取得重要进展
2016年10月3日,《自然》(NATURE)期刊在线发表了中国科学院生物物理研究所柳振峰课题组关于三聚态胞内阳离子通道(TRimeric Intracellular Cation channel, TRIC channel)的结构与门控机制研究成果。
钙离子在生物体和细胞的生理活动过程中发挥重要的作用,作为信使参与细胞信号传递过程,也是骨质的重要组成成分。细胞内钙离子信号及其浓度的调控对肌肉收缩、神经递质释放、细胞生长和凋亡等生理过程至关重要。肌质网或内质网(SR/ER)腔内所贮存的钙离子主要通过兰尼碱受体(ryanodine receptor, RyR)或三磷酸肌醇受体(IP3R)通道来释放,该过程的调控需要得到SR/ER膜上的一系列其它离子通道的支持。快速释放的钙离子会在SR/ER管腔内产生局部负电位,导致跨膜电位的失衡,进而阻碍钙离子的有效释放。因此,对于细胞内钙信号的调控不仅需要RyR和IP3R通道来释放钙离子,还需要其它SR/ER离子通道来为其提供反向电流以恢复SR/ER膜电位的平衡和维持腔内离子的稳态。近年来,TRIC通道被发现是一种位于SR/ER膜上的单价阳离子通道,它们主要通过通透钾离子或钠离子来促进SR/ER腔内的钙离子向胞浆释放。编码TRIC通道蛋白的基因遗传缺失或突变会导致高血压、心脏病、呼吸缺陷和脆骨病。脆骨病也称成骨不全症,患者先天骨质脆弱易折,统计数据显示该病在人群中的发生率约为1/20,000。TRIC通道家族包含A型和B型两个亚型,其中B亚型的TRIC-B与呼吸缺陷和脆骨病的发生有关。
近年来,科学家们围绕TRIC通道的生理功能、分子遗传学和电生理特征等方面开展了一系列的研究,而其分子水平的三维结构与门控机制多年来一直是个谜。柳振峰课题组利用上海光源生物大分子晶体学线站(BL17U1)和日本光子工厂(PF)率先解析了秀丽线虫(Caenorhabditiselegans)来源的TRIC-B(CeTRIC-B)通道的两个不同构象态的晶体结构,首次发现了TRIC-B通道蛋白能够特异性地结合内源性的磷脂酰肌醇4,5-二磷酸(PIP2)脂类分子,并形成了稳定的同源三聚体复合物(如下图所示)。每个单体中各含有一个可通透K+离子等单价阳离子的不对称孔道,其结构特征与经典的四聚态K+离子通道截然不同。内源性的PIP2分子介导了TRIC通道的三聚化,同时直接参与孔道结构的形成,并与推测的电压感应基序以及钙离子结合区有相互作用。这一发现揭示了PIP2分子在胞内离子通道中所起的关键作用,也拓展了人们对于PIP2与离子通道相互作用关系的认识。胞质侧的钙离子对于TRIC通道的活化有促进作用,研究结果发现TRIC-B通道在结合钙离子前后发生了局部结构的变化,并基于此提出了该通道活化过程的机理模型,对其开放时的门控机制做出了预测。
新型胞内离子通道是潜在的药物作用靶点,相关研究有望促进新药的开发,该领域的研究工作近年来开始引人关注。此次所完成的TRIC通道结构机理方面的研究结果,将为深入开展关于胞内钙信号动态调控以及有关的生理过程、病理以及药理的分子基础研究提供全新的视角。
原文链接:http://www.nature.com/nature/journal/vaop/ncurrent/full/nature19767.html
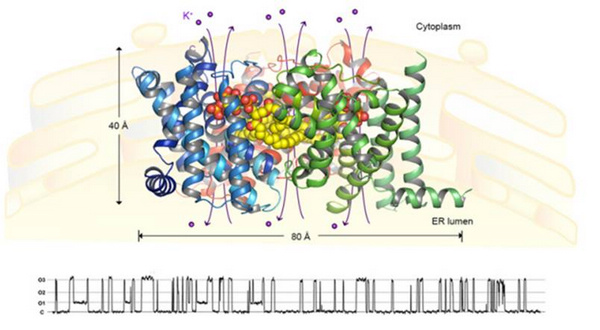
图示:三聚态TRIC-B1-PIP2复合物的整体结构和单通道电生理行为。图中蓝色、绿色和红色飘带模型为蛋白质分子的三维结构(沿膜平面的侧面观),黄-红色球状模型表示参与通道门控的磷脂(PIP2)分子。结构的下方为该通道的开放时所显示出来的微电流活性图(通过单通道膜片钳方法记录测得)。C和O1-O3分别代表通道的关闭状态和三个不同的开放态。
附件下载:
