您现在的位置:首页 > 研究亮点
2018年5月24日,北京市软物质科学与工程高精尖创新中心、北京化工大学生命学院冯越教授研究组在《Nature》在线发表了题为《Structural basis of ubiquitin modification by the Legionella effector SdeA》的研究长文(Article),报道了嗜肺军团菌内一种新型的泛素修饰与连接酶——SdeA及其与泛素复合物的晶体结构,揭示了其修饰泛素及催化新型泛素化过程的工作机理。
泛素化是泛素蛋白在特定酶的作用下,对底物蛋白进行特异性修饰的过程,几乎参与一切生命活动的调控,与肿瘤、心血管等疾病的发病也密切相关。嗜肺军团菌是军团菌肺炎这一潜在致死性肺炎的致病微生物。最新的研究发现,该细菌的SdeA蛋白以一种全新的、完全不同于经典泛素化的方式修饰泛素,并催化其对几种内质网相关蛋白的泛素化过程。
在该论文中,冯越研究组利用上海光源生物大分子晶体学线站(BL17U1)和蛋白复合物线站(BL19U1)解析了SdeA及其与泛素复合物的三维结构,揭示了SdeA活性中心的组成,阐明了其识别泛素的机理,并提出了SdeA修饰泛素过程中泛素的构象变化假设。该研究的创新性和科学意义在于:一方面,SdeA是目前为止世界上首个鉴定出的新型泛素连接酶,其与泛素复合物结构的解析揭示了一种全新的泛素化的结构机理。由于哺乳动物也含有类似结构,同时其他细菌可能也具有类似的、尚未发现的泛素化系统,所以在未来,该研究将帮助鉴定出其它新型泛素化系统,从而丰富我们对细胞生命过程的认知;另一方面,SdeA的结构解析也为设计针对该家族蛋白的小分子抑制剂,作为治疗军团菌肺炎的潜在抗生素奠定了重要基础。
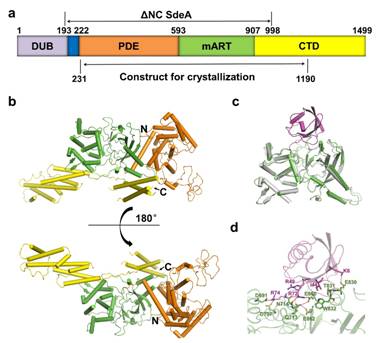
图:SdeA及其与泛素复合物的三维结构








