2014年11月11日,复旦大学生物医学研究院研究员、附属肿瘤医院双聘教授徐彦辉带领其课题组成员在国际顶级学术期刊《自然》(Nature)上在线发表了题为“Structural insight into autoinhibition and histone H3-induced activation of DNMT3A”的研究成果。这也是徐彦辉课题组继2013年在国际顶级学术期刊《细胞》(Cell)报道的DNA去甲基化关键蛋白TET2与DNA复合物三维结构之后,在表观遗传学领域做出的又一重大成果。
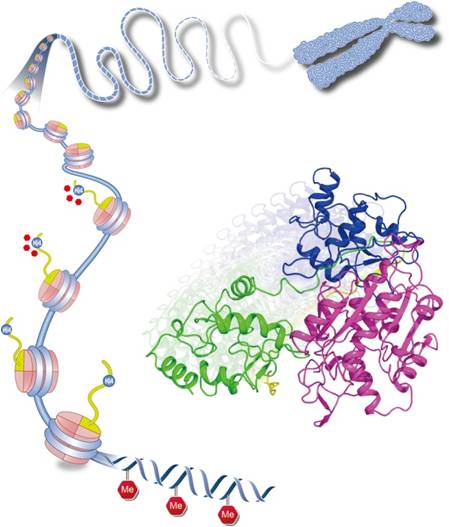
众所周知,DNA(脱氧核糖核酸)构成基因组,是生命遗传信息的基本载体。人体的DNA存在一种至关重要的化学修饰,即甲基化修饰,它起到一个开关的作用,决定特定基因的表达或失活。基因组上DNA甲基化在胚胎发育过程中发挥重要作用,甲基化模式的紊乱与许多癌症及发育失调综合征有密切关系。这个修饰是由DNA甲基转移酶DNMT3A及其家族成员完成的。在急性骨髓性白血病(Acute Myeloid Leukemia, AML)患者中,编码DNMT3A的基因经常携带突变,并且携带突变的患者往往预后更差。DNMT3A如何在基因组上精确建立DNA甲基化,一直是这个领域研究的难点。
徐彦辉课题组经过多年不懈探索,终于揭开这一科学难题。利用上海光源生物大分子晶体学线站(BL17U1)首次解析了人源DNA甲基转移酶DNMT3A抑制状态和激活状态的晶体结构,揭示了基因组DNA甲基化修饰建立的分子机制。他们研究发现,作为执行DNA甲基化修饰的酶,DNMT3A有负责催化的功能单元(CD)和负责调节自身活性的调节单元(ADD),调节单元结合催化单元并抑制其与DNA的结合,从而使DNMT3A处于低活性的状态,保证DNMT3A不会随意在基因组上建立甲基化修饰。基因组上大量存在的组蛋白H3能够结合其调节单元,引导调节单元离开催化单元,使催化单元充分暴露并容易接触到DNA,即产生高活性状态的DNMT3A。如果组蛋白H3第四位赖氨酸有甲基化修饰,DNMT3A也不被激活。生命体聪明地利用该机制,保证了只有在无修饰组蛋白H3存在的基因组附近,DNMT3A才处于高活性状态,周围的DNA才可以发生甲基化修饰,使得甲基化只出现在需要的基因组区域。该发现也很好地解释了为什么DNA甲基化与未修饰的组蛋白H3大都同时存在于相同基因组位置上。这项工作首次从分子水平上揭示了DNMT3A活性调控的机制,丰富了人们对DNA甲基化建立机制的认识,为日后设计DNMT3A活性调控药物用以治疗白血病提供了重要的分子基础。(生命科学研究部 供稿)