清华大学医学院基础医学系和结构生物学中心李海涛课题组日前在国际权威学术期刊《自然》(Nature,2014年3月2日)和《基因与发育》(Genes & Dev,2014年3月3日)在线发表两篇论文,从结构生物学角度解析组蛋白甲基化修饰识别新机制,进一步揭开了错综复杂的表观遗传调控(epigenetic regulation)的神秘面纱。
真核生物基因表达调控不仅依赖于特定的DNA序列元件,而且还受到特定组蛋白翻译后修饰的精密调节。目前鉴定出的组蛋白修饰化学类型已超过25种,包括甲基化、酰基化、磷酸化等。这些组蛋白修饰及其组合被认为构成一组广义上的“组蛋白密码”,是表观遗传调控的重要机制之一。此外,各种组蛋白(H1,H2A,H2B,H3和H4)还普遍存在不同的序列变体。组蛋白变体和组蛋白修饰赋予组蛋白巨大的信息荷载能力,参与构成一层超越DNA序列的表观遗传信息,在染色质结构调节及基因表达调控等过程中起着关键作用。目前发现很多疾病与组蛋白修饰异常有着非常重要的关联,因此研究组蛋白修饰的产生,消除以及读取机制,对深入了解基因功能调控机制以及疾病的发生和治疗等都有着重要意义。
清华大学李海涛课题组利用上海光源生物大分子晶体学线站(BL17U1),解析了bromo-PWWP-H3.1K36me3复合物和bromo-PWWP-H3.3K36me3复合物的晶体结构,结合从北京光源获得的free bromo-PWWP晶体结构数据,在原子水平精细阐释了一种肿瘤抑制因子ZMYND11,利用其串联“Bromo-ZnF-PWWP”结构域识别组蛋白变体H3.3K36me3修饰的分子机制(图1a),相关论文发表在《自然》杂志上。功能实验与生物信息学分析进一步表明ZMYND11通过识别组蛋白H3.3K36me3修饰,在转录延伸水平抑制了肿瘤发生相关基因的过度表达,进而抑制肿瘤发生。该论文首次揭示出生物体内存在组蛋白变体特异的甲基化识别蛋白。这种对组蛋白变体和甲基化修饰类型的双重识别,是组蛋白修饰识别机制上的新亮点,体现了真核生物表观遗传调控的复杂性和重要性。本论文是在清华大学李海涛实验室、美国德克萨斯大学安德森癌症中心的施晓冰助理教授实验室以及美国贝勒医学院的李蔚助理教授实验室的通力协作下完成的。整个研究涵盖了结构生物学、细胞生物学和功能基因组学等内容,充分体现了当前生命科学研究中多学科深度交叉的趋势。
此外,李海涛课题组利用上海光源生物大分子晶体学线站(BL17U1)还解析了Spindlin1及其复合物的晶体结构,并在《基因与发育》杂志上报导了Spindlin1蛋白特异识别一种新型组蛋白甲基化修饰组合H3“K4me3─R8me2a”的分子结构基础,结合细胞生物学研究,探讨了该识别在结肠癌Wnt信号通路中的激活调控作用(图1b)。Spindlin1是Spin/Ssty家族成员之一,参与细胞周期的调控,在多种肿瘤中高表达。结构研究表明Spindlin1分别通过串联Spin/Ssty结构域2和1特异性识别组蛋白H3K4me3和H3R8me2a甲基化修饰;利用等温量热滴定法测定该识别的结合常数高达45纳摩尔,是目前已报导的结合力最强的组蛋白修饰识别事件,充分显示了组蛋白修饰多价态识别的潜力。(生命科学研究部 供稿)
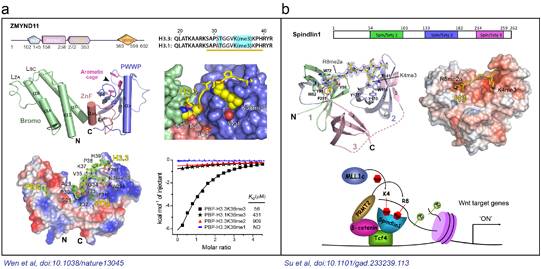
图1. a) 组蛋白H3.3K36me3被ZMYND11串联Bromo-ZnF-PWWP结构域识别;b)组蛋白H3“K4me3-R8me2a”被Spindlin1串联Spin/Ssty结构域组合识别。








